维多利亚vic309官网杨朝勇教授课题组与美国亚利桑那州立大学颜颢教授课题组合作,在光控酶通路的仿生构建方面取得进展,相关研究成果”A Synthetic Light-Driven Substrate Channeling System for Precise Regulation of Enzyme Cascade Activity Based on DNA Origami”发表于J.Am.Chem.Soc. (DOI: 10.1021/jacs.8b05429)。
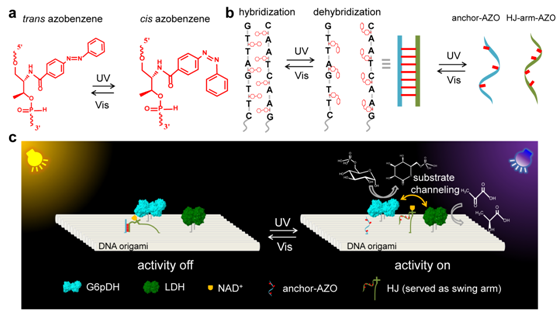
生物体内的级联酶反应具有催化速度快、选择性好和反应条件温和等优点,对于合成生物学、生物医学等领域有重要的借鉴意义。作为级联酶反应的机理之一,底物通道通过摆臂直接将代谢中间物传递给下一个酶而避免底物扩散到溶液中,不仅提高酶反应的选择性,而且大大加速酶反应速率。为了进一步理解底物通道的机理并探索其在合成生物学中的应用,研究团队结合DNA折纸术( DNA origami)和光响应偶氮苯分子,在体外仿生构筑了光驱动底物通道系统用以级联酶催化反应活性的调控。
DNA折纸结构具有精确的可寻址性、纳米级的空间分辨率和优异的动态可调性能,是一类介导纳米颗粒、蛋白、小分子等客体的精确组装及功能调控的理想材料。该工作以长90nm、宽60nm的方形DNA折纸结构作为模板,实现了G6pDH-LDH蛋白酶及其辅酶因子的精确组装,并可精准调控级联酶之间的水平距离,从而调控级联酶的催化活性。
利用底物通道在级联酶反应中的重要作用,研究团队将光敏的偶氮苯分子修饰在摆臂和锚点DNA链上,借助偶氮苯分子的结构光响应性调控辅酶因子NAD+/NADH的摆动方向,从而实现快速、可逆、无污染的酶通路活性调控。在可见光下,反式的偶氮苯可促使摆臂和锚点杂交,使得辅酶因子远离酶通路,进而降低酶通路活性;而在紫外光下,反式的偶氮苯使摆臂和锚点去杂交解链,促使辅酶因子在级联酶之间的自由摆动,从而提高酶通路活性。该策略实现了级联酶活性快速、可逆的光调控,为合成生物学、生物医学等领域提供一种蛋白活性光调控的新思路。
该工作在杨朝勇教授、柯国梁博士(现湖南大学助理教授)和颜颢教授的共同指导下完成,第一作者为2016级能源材料化学协同创新中心(iChEM)博士生陈雅鸿,已毕业博士研究生马艳丽参与部分实验。该工作得到了国家自然科学基金委和教育部(长江学者和创新团队发展计划)的资助。
