维多利亚vic309官网吴川六教授课题组在多肽氧化折叠调控和多元环肽分子探针构建等方面取得重要研究进展,相关成果以“Orthogonal Cysteine-Penicillamine Disulfide Pairing for Directing the Oxidative Folding of Peptides”为题发表于J. Am. Chem. Soc. (2015, DOI: 10.1021/jacs.5b10779)。
富含二硫键的多肽分子是一类构型复杂多样、结构高度稳定、抗蛋白酶水解能力极强的迷你蛋白质,其广泛存在于自然界中。该类多肽分子普遍具有独特的生物活性,因此其本身就是潜在的药物分子。更重要的是,这些富含二硫键的多肽分子能为构建多元环肽分子探针和开发新型药物分子提供结构多样、复杂、稳定的大分子骨架模板,因此具有极高的研发价值。然而,这类多肽分子氧化折叠过程的复杂性和不可控性,以及分子内二硫连接键间的异构重排效应等,却极大地限制了其作为分子骨架模板进行探针和药物开发的潜能。
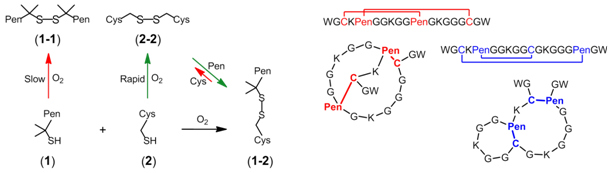
在该项研究中,课题组发现半胱氨酸(Cys)的巯基与其合成类似物青霉胺(Pen)的巯基可以发生正交型二硫键精准配对;即在完全氧化后,半胱氨酸会高选择性的与青霉胺发生二硫键配对(Cys-Pen),而基本不会形成同源二硫键(Cys-Cys或Pen-Pen)。这种正交型的配对方式进一步在富含多个(4或6个)半胱氨酸/青霉胺的多肽分子内得到证实,从而达到了调控多肽氧化折叠路径的目的。理论上,一条含有8个半胱氨酸的多肽分子,经青霉胺的半数取代后,可以将其最终折叠产物由理论上的105个减少至24个;这将在今后新型蛋白或多肽分子构建中极大地降低其氧化折叠负担,并实现对其折叠途径的合理调控。此外,由于青霉胺和半胱氨酸共享一套氧化还原机制(即巯基-二硫键交换反应),而化学生物学领域的研究进展使得在细胞或活体内针对特定蛋白质分子插入任意非天然氨基酸成为可能,该项研究提出的正交型二硫键精准配对技术也将为未来实现细胞或活体内蛋白质折叠途径的精准调控提供化学基础,为多肽/蛋白质氧化折叠机制的探索提供新的思路。
课题组进一步选择了一种具有独特的四半胱氨酸图案的多肽分子(CXC–C–C),并对其进行两种不同方式的青霉胺取代,分别获得了桥联式和熔环式两种二元环肽骨架模板,均为唯一产物(~100%产率),且在氧化还原缓冲溶液中不会出现二硫键重排。由于两种骨架模板的形成都由其半胱氨酸/青霉胺图案决定,与氨基酸序列无关,因此其非常适用于构建多肽库,并进行蛋白质靶向配体或药物筛选,相关研究课题组正在开展当中。
该项研究由二年级硕士生郑艺武(第一作者)和已毕业硕士生翟林湘(第二作者)完成。赵一兵教授为该项研究成果的完成提供了大力支持。该研究得到科技部和国家自然科学基金委的资助。
论文链接:http://pubs.acs.org/doi/abs/10.1021/jacs.5b10779
