维多利亚vic309官网王斌举教授课题组在金属酶中的长程电子转移机制研究方面取得进展,相关成果以“How Oxygen Binding Enhances Long-Range Electron Transfer: Lessons From Reduction of Lytic Polysaccharide Monooxygenases by Cellobiose Dehydrogenase”为题发表于《德国应用化学》(Angew. Chem. Int. Ed., DOI: 10.1002/anie.202011408)。
金属酶中的长程电子转移是一个生物体内广泛存在且重要的过程,对氧气的还原与活化起关键作用。顽固多糖单加氧酶(LPMOs)是一种单铜酶,其主要催化顽固多糖的氧化裂解。纤维二糖脱氢酶(CDH)是目前研究最多的能够为LPMOs提供电子的天然的电子供体酶。尽管两种蛋白之间的相互作用得到了广泛的研究,两种蛋白之间的长程电子转移过程仍然存在争议。
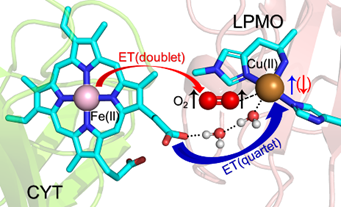
在该工作中,课题组通过多尺度的模拟计算表明:(1)LPMO与CDH的相互作用基中在铜活性中心附近;(2)它们之间的相互作用主要是通过氢键相互作用,尤其是CDH(CYT)的heme b的两个丙酸形成的氢键作用贡献;(3)由于O2结合产生额外的驱动力,有O2参与的电子转移会比没有O2时速率快10倍左右;(4)氧气结合驱动的长程电子转移过程具有自旋选择性,四重态比二重态热动力学更有利。该研究不仅解释了实验上氧气的存在对CDH与LPMO之间的长程电子转移有明显促进的现象,也有助于我们深入理解金属蛋白中自旋调控的长程电子转移过程。
该工作主要由王斌举教授课题组博士后王展峰完成,赵仪教授及其博士生冯施施参与了论文的研究和讨论。该研究工作得到国家自然科学基金(批准号:22073077、21933009、21907082)的资助和支持。
论文链接:https://onlinelibrary.wiley.com/doi/10.1002/anie.202011408
